Der äußere Lichtelektrische Effekt (Photoeffekt)
1. Experiment (qualitativ):
Eine negativ geladene Zinkplatte wird mit UV-Licht bestrahlt. Licht als elektromagnetische Welle (so dachte man) versetztElektronen in Schwingung bis sie sich aus dem Metall ablösen.Beobachtung:
Das Elektroskop zeigt abnehmende Ladung an. Schiebt man eine Glasplatte ein, so erfolgt keine Entladung.Erklärung:
- nach Wellentheorie: Elektronen von Lichtwelle zu Schwingung angeregt
- größte Lichtintensität ⇒ elektrische Feldstärke größer
- Elektronen sollen mit größerer Amplitude schwingen ⇒ werden leichter aus Metall abgelöst
Widerspruch zu den Beobachtungen:
- bei Bestrahlung mit sichtbarem Licht ⇒ keine Elektronen abgelöst
- selbst wenn man die Intensität sehr stark erhöht
- nur hochfrequentes UV-Licht löst Elektronen aus (selbst bei sehr niedriger Intensität)
2. Experiment (quantitativ): Gegenfeldmethode
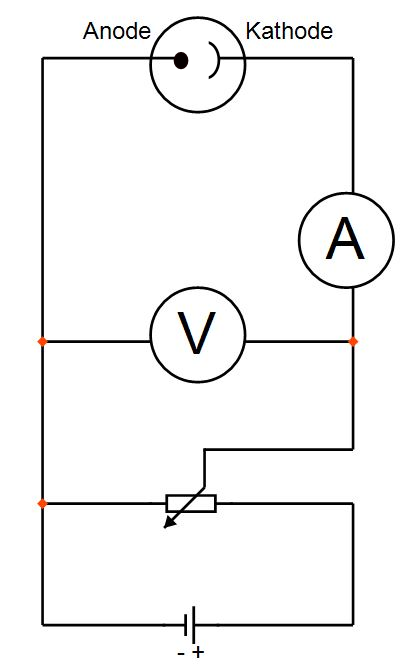 | Durch Licht einer Quecksilberspektralröhre wird die Fotokathode bestrahlt. Das Licht wird durch ein Gitter in seine Spektrallinien zerlegt. Es werden wie beim 1. Experiment Elektronen aus der Kathode herausgelöst. Diese gelangen zur Anode. Nun wird die Spannung solange erhöht bis kein Elektron die Anode erreicht (I = 0). Dazu ist an der Photozelle eine veränderliche Gegenspannung angelegt.Messwerttabelle:
|
Gleichungen:
c = λ·fEel = e·U=Ekin
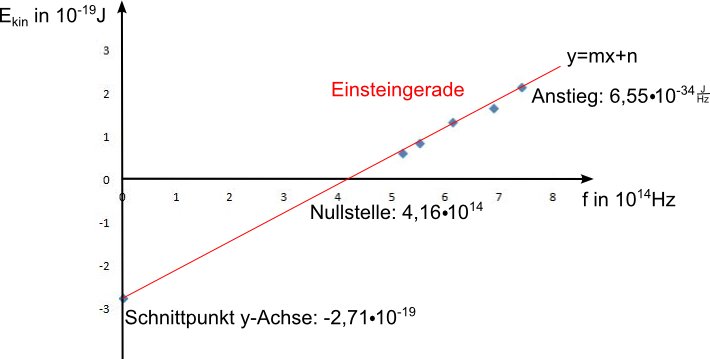
Ergebnisse des Experiments:
- Licht ab einer bestimmten Frequenz kann aus Metallen Elektronen herauslösen.
- Die kinetische Energie der ausgelösten Elektronen ist unabhängig von der Beleuchtungsstärke.
- Die beim Fotoeffekt auf ein ausgelöstes Elektron übertragene Energie wächst mit der Frequenz direkt proportional
Deutung nach Einstein:
Ekine + WA = ELichtElektron Licht
Teilchen
Licht zeigt Teilcheneigenschaften
Energiebetrachtung
Ekine = m·f - WAEkine... kinetische Energie der Elektronen
m... Anstieg der Geraden
WA... Austrittsarbeit der Elektronen
Anstieg = Plancksches Wirkungsquantum h=6,62·10-34Js
Ekine + WA = ELicht
Metalle X, Y und Z mit WAX > WAY > WAZ

Energie des Lichts: E = h·f
Entweder gibt Licht seine gesamte Energie an das Elektron ab, oder es passiert nichts!
Einstein: E = m· c2 folgt
Masse des Lichts: m =
h·fc2
Impuls des Lichts: p = m·c =
h·fc2
·c =h·fc
mitf = cλ
folgtp = cλ
Es ergeben sich folgende Ergebnisse:
- die klassischen Teilchen Elektronen zeigen auch Wellencharakter (Materiewelle/ de Broglie-Wellen ⇒ Beugung)
- die klassische elektromagnetische Welle Licht zeigt auch Teilchencharakter (Photon ⇒ Impuls)
Dieses oft unter dem Begriff "Dualismus" subsummierte nicht mehr klar unterscheidbare Verhalten von Welle und Teilchen imMikrokosmos ist ein wesentliches Kennzeichen der Quantenphysik. Deshalb fasst man die Mikroobjekte auch als "Quanten"zusammen, die alle ein ähnliches Verhalten zeigen.
Eigenschaften von Quantenobjekten:
Im Unterschied zu den uns umgebenden makroskopischen Körpern gilt für Quantenobjekte:
- Quantenobjekte bewegen sich nicht auf Bahnen
- Quantenobjekte sind keine kleinen Kügelchen
- bei Quantenobjekten treten Teilchen- und Welleneigenschaften auf
- Welliges, was ihre Ausbreitung bestimmt und z.B. auch Interferenz bewirkt
- Körniges oder Teilchenhaftes, was sich z.B. bei einer Ortsmessung zeigt
- Stochastisches, was keine Aussage über das Verhalten eines einzelnen Quantenobjekts erlaubt, wohl aber Wahrscheinlichkeitsaussagen für eine große Anzahl von Quantenobjekten
Taylor-Experiment:
- Beugung und Interferenz sind nicht abhängig von der Lichtintensität
- je höher die Intensität ⇒ Welleneigenschaften
- je niedriger die Intensität ⇒ Teilcheneigenschaften
Vergleich Lichtmikroskop - Elektronenmikroskop:
| Lichtmikroskop | Elektronenmikroskop |
|---|---|
| Das Objekt wird mit Licht durchstrahlt | Das Objekt wird mit schnell bewegten Elektronen durchstrahlt |
| Die Abbildung erfolgt durch optische Linsen (Nutzung der Brechung von Licht) | Die Abbildung erfolgt durch Magnetlinsen (Nutzung der Ablenkung von Elektronen in Magnetfeldern) |
| Es entsteht ein vergrößertes Bild des Objekts, das mit den Augen betrachtet oder fotografiert werden kann | Es entsteht ein vergrößertes Bild des Objekts, das mit den Augen betrachtet oder fotografiert werden kann |
| Meist wird mit 20facher bis 1000facher Vergrößerung gearbeitet | Die Vergrößerung ist etwa um den Faktor 103 größer als bei einem Lichtmikroskop |
| Das Auflösungsvermögen ist durch die Wellenlänge des Lichts begrenzt (bei blauem Licht 0,4µm) | Das Auflösungsvermögen ist durch die Beschleunigungsspannung begrenzt (bei 100kV ⇒ 0,3nm) |
Das Bohrsche Atommodell
Planetenmodell (Rutherford 1911):
Elektronen kreisen auf beliebigen Bahnen mit beliebiger Neigung um den positiven Atomkern.Coulombkraft FQ = Zentrifugalkraft FZ
(1)
12·π·ε0
· e2r2
= m·v2r
unverstanden bei diesem Modell sind:
- die stabilen Kreisbahnen, da die negativ geladenen Elektronen unter Abgabe von Strahlung innerhalb kürzester Zeit in den Kern stürzen würden
- die Spektrallinien
Bohrsches Atommodell (1913):
1.Postulat:
Das Atom hat eine Anzahl stationärer, d.h. strahlungsarmer Zustände. In jedem dieser Zustände hat es einen bestimmten Energiegehalt En(2) me·vn·2·π·rn = n·h Bohrsche Quantenbedingung
n... Hauptquantenzahl n=1, 2, 3, ...
Die Wirkung des umlaufenden Elektrons ist gleich einem ganzzahligen Vielfachen von h.
2.Postulat:
Der Übergang von einem dieser Zustände En zu einem anderen Em erfolgt sprunghaft unter Aufnahme bzw. Abgabe eines Lichtquants: QuantensprungDaraus folgt mit der Energie für ein Lichtquant: E = h·f
h·f = Em - En Bohrsche Frequenzbedingung
Das erste Postulat gilt nur, wenn die elektrostatische Anziehungskraft gleich der Radialkraft ist. Aus Gleichung (1) folgt:
(3)
e24·π·ε0
=me·v2·rnAus der Bohrschen Quantenbedingung folgt für die Bahngeschwindigkeit vn:
(4)
n·h2·π·me·rn
Diese Gleichung quadriert und in Gleichung (3) eingesetzt ergibt:
(5)
e24·π·ε0
= n2·h24·π2·me·rn
Umgestellt nach dem Bahnradius ergibt sich:
(6) rn =
ε0·h2π·e2·me
·n2 =5,29·10-11m·n2Gleichung (6) in Gleichung (4) eingesetzt ergibt die Geschwindigkeit des Elektrons im Grundzustand eines Wasserstoffatoms:
vn =
e22·ε0·h
·1n
= 2,19·106ms
·1n
Die Energie des Elektrons auf einer Bahn ist die Summe aus der
kinetischen Energie: Ekin =
12
·m·v2 =12
·me·e44·ε02·h2
·1n2
=e4·me8·ε02·h2
·1n2
und potenziellen Energie ("Hubarbeit"): Epot = Fel·r =
14·π·ε0
·e2r2
·r =- e24·π·ε0·rn
=- e2·π·e2·me4·π·ε0·ε0·h2·n2
=- 14
·e4·meε02·h2
·1n2
Gesamtenergie: Ekin + Epot = -
18
· e4·meε02·h2
· 1n2
Berechnung der Energie des Elektrons im Grundzustand (n=1) E1 = -2,18·10-18J = -13,6eV für Wasserstoff
⇒ En = -13,6eV·
1n2
Energieniveauschema für Wasserstoff:
 | Balmer Serie (teilweise sichtbar) Lyman Serie (ultraviolett) Paschen Serie (infrarot) |
Emission:
- Aussenden von Licht
- Zufuhr von Energie ⇒ Stoff leuchtet ⇒ gibt Licht ab
- Abgabe von Energie aus Atomhülle
Absorption:
- Aufnahme von Energie
- jeder Stoff absorbiert Licht mit derselben Wellenlänge, mit der er Licht emittiert ⇒ Absorptionsspektrum
Serienformel für Wasserstoff:
f = fRy·(1m2
-1n2
)fRy... Rydbergfrequenz fRy=3,28984195·1015Hz
EPhoton = h·fRy·(
1m2
-1n2
)EPhoton = 13,6eV·(
1m2
-1n2
)En = -h·Ry·
1n2
in der Einheit J fRy = RyAnregung durch:
| Licht | Teilchen (Elektronen) |
| ΔE = Em - En = h·f vollständige Energieabgabe | teilweise Energieabgabe |
Arten von Spektren:
- Kontinuierliches Spektrum:
- glühende Festkörper, Flüssigkeiten und Gase unter hohem Druck
- Linsenspektrum:
- Gase unter geringem Druck
- Absorptionsspektrum:
- jeder Stoff kann genau die Wellenlänge absorbieren die er selbst aussenden würde
- es kommt zur Anregung der Atome
Vorzüge und Mängel des Bohrschen Atommodells:
| Vorzüge | Grenzen |
|---|---|
| trägt als erstes Modell der Tatsache Rechnung, dass die klassische Physik Atome nicht richtig beschreiben kann | im Rahmen der klassischen Physik sind Postulate unverständlich und erscheinen willkürlich |
| erklärt alle Emissions- und Absorptionsvorgänge richtig als Energieänderung der Valenzelektronen | der klassische Begriff "Bahn" setzt genaue Kenntnis des Ortes voraus; Widerspruch zur Unschärferelation |
| Serienformel des Wasserstoffspektrums lässt sich sehr genau herleiten | Widersprüche bei der Behandlung von Mehrelektronensystemen |
| Rydbergkonstante und Ionisierungsenergie des Wasserstoffs lassen sich durch Konstanten ausdrücken | Gestalt des Wasserstoffatoms mittels Bohrscher Theorie eine Scheibe, keine Kugel |
| Spektren wasserstoffähnlicher Atome und Ionen lassen sich sehr genau berechnen | keine Aussagen über Intensität oder Polarisation der vom Wasserstoff emittierten Strahlung |
| Durchmesser des Wasserstoffatoms wird größenordnungsmäßig richtig bestimmt | liefert die magnetischen Eigenschaften nicht richtig |
Einelektronensysteme
 | Wasserstoffatom | 1H | 1·e·e = 1e2 |
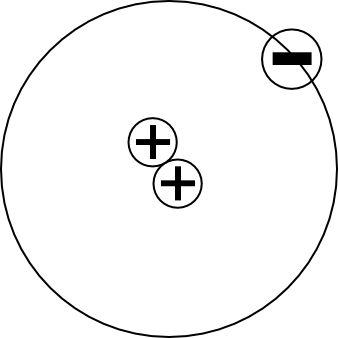 | Heliumion | 2He+ | 2·e·e = 2e2 |
 | Lithiumion (zweifach ionisiert) | 3Li2+ | 3·e·e = 3e2 |
Orbital:
Bereich der höchsten Aufenthaltswahrscheinlichkeit φ2 ⇒ jede Spektrallinie hat eine natürliche BreiteLumineszenz:
- = inverser Photoeffekt
- Eel→ELicht
- z.B. LED
Phosphoreszenz:
- verzögerte Emission (in mehreren Stufen)
- ⇒ Stoffe leuchten noch längere Zeit
- Absorption energiereichen Lichts; kurzwellig → langwellig
Fluoreszenz:
- kleinerer Energiebetrag emittiert als absorbiert
- ⇒ dafür muss freies Energieniveau zur Verfügung stehen
- ⇒ emittiertes Licht ist langwellig
Der Laser
prinzipieller Aufbau:
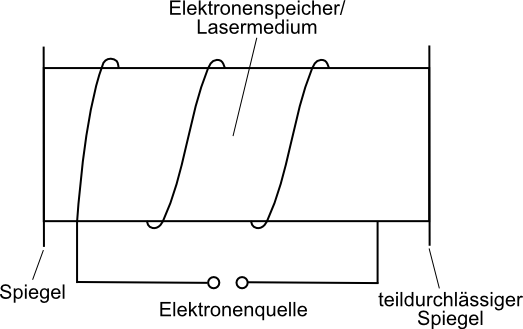 | Plattenkondensator mit isolierender Folie, dessen eine Platte geteilt ist ⇒ diese Teile sind mit hochohmigem Widerstand verbunden |
Eigenschaften Laserlicht:
- Laserlicht ist nahezu paralleles Licht
- Laserlicht ist Licht einer Frequenz bzw. einer Wellenlänge (monochromatisches Licht)
- Frequenz (λ, Farbe) hängt vom Lasermedium ab
- Laserlicht kann eine hohe Leistungsdichte von bis zu einigen MWt/cm2 erreichen
spontane und induzierte Emission:
| spontane Emission | induzierte Emission |
|---|---|
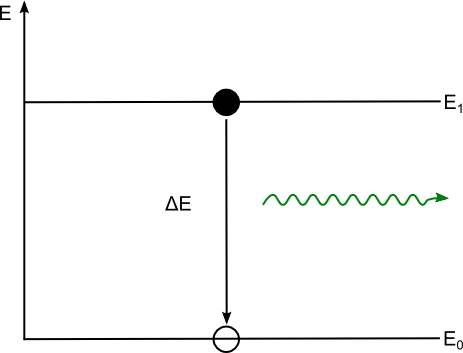 |  |
| Angeregter Zustand besteht nur ca. 10-8s. Die Emission erfolgt ohne äußere Einwirkung | Angeregter Zustand besteht mehr als 10-2s. Die Emission wird durch Photonen stimuliert |
| z.B. glühender Wolframdraht | z.B. Laser |
Röntgenstrahlung
elektromagnetisches Spektrum:
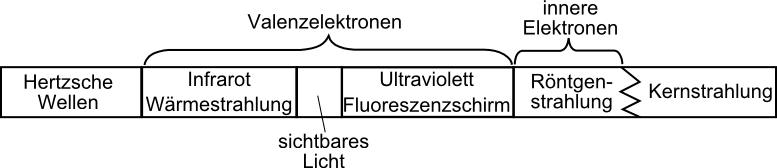
Röntgenspektrum:
- niedrigste Energieniveaus im Atom frei ⇒ durch andere Elektronen der Atomhülle besetzt
- Wellen im Bereich von 10-10m
- Wellen an Atomen in Netzebenen gebeugt ⇒ interferieren 2·a·sin φk = k·λ a... Abstand der Netzebene
- Elektronen treffen mit hoher Spannung UB auf die Anode
- ⇒ Wechselwirkung ⇒ Energie als Strahlung abgegeben

