Thermodynamische Systeme

p... Druck
V... Volumen
T... Temperatur (in Kelvin)
U... innere Energie
Q... Wärme
W... Arbeit
- Idealisierung; für die Betrachtung spielt die Temperatur eine entscheidende Rolle
- Festlegung der Systemgrenzen ist willkürlich und wird von der Aufgabenstellung bestimmt
- thermodynamisches System befindet sich in einem Zustand; durch Zustandsgrößen (p, V, T, U) bestimmt
- physikalische Größen, die die Wechselwirkung zwischen System und Umgebung beschreiben heißen Prozessgrößen (Q, W)
Betrachtungsweisen:
| phänomenologische | kinetisch-statistische |
|---|---|
| Erfassung und Beschreibung makrophysikalischer (messbarer) Größen | Beschreibung der Eigenschaften der Stoffe und ablaufender Prozesse auf Grundlage der Bewegung von Teilchen |
Beispiel: Druck
|
|
| p= FA ; F⊥A |
|
Beispiel: Verdunsten
|
|
Zustandsänderung für ideale Gase
Isotherme Zustandsänderung:
| T=konstant p1·V1=p2·V2 p·V=konstant Boyle-Mariotte'sches Gesetz Robert Boyle (1627-1690) Edme Mariotte (1620-1684) |  |
Isochore Zustandsänderung:
| V=konstant p1T1 = p2T2 pT =konstantGesetz von Amontons Guillaume Amontons (1663-1705) |  |
Isobare Zustandsänderung:
| p=konstant V1T1 = V2T2 VT =konstantGesetz von Gay-Lussac Joseph Louis Gay-Lussac (1778-1850) |  |
Allgemeine Zustandsgleichung für ideale Gase
p·VT
=konstantp1·V1T1
=p2·V2T2
Ein Gas, welches diese Gleichung vollständig erfüllt, heißt ideales Gas. (phänomenologische Aussage)
Universelle Gasgleichung:
universelle Gaskonstante: R=8,31451Jkg·mol
universelle Gasgleichung: p·V=n·R·T
mit n=
mM
undRS=RM
folgtp·V=m·RS·TProzessgrößen
Volumenarbeit:
| Isobare Zustandsänderung | Isotherme Zustandsänderung |
|---|---|
 p = konstant F = p·A W = F·Δs = p·A·Δs W = -p·ΔV |  T = konstant p·V = n·R·T = konstant W = -V2∫V1p·dV = -V2∫V1 n·R·TV ·dVW = -n·R·T·V2∫V1 1V ·dV = -n·R·T·ln VV2∫V1W = n·R·T·ln V1V2 |
Die Fläche unter der Kurve im p(V)-Diagramm ist ein Maß für die Volumenarbeit.
Vorzeichenregel:
Einem System zugeführte Energie in Form von Arbeit bzw. Wärme ist positiv. Eine vom System abgegebene Energie in Form von Arbeit bzw. Wärme ist negativ.
Volumenarbeit allgemein: W = -V2∫V1 p·dV
Wärme:
Die Wärme gibt an, wie viel thermische Energie von einem System auf ein anderes übertragen wird.
Formelzeichen: Q
Einheit: J (Joule)
Unter der Bedingung, dass keine Änderung des Aggregatzustandes erfolgt, gilt die zugeführte oder abgegebene Wärme:
Q = c·m·ΔT
c... spezifische Wärmekapazität
m... Masse des Körpers
ΔT... Temperaturänderung
Beachte: für Gase cp... Druck konstant; cV... Volumen konstant
weitere Wärmen:
| Wärme bei Aggregatszustandsänderung | Wärme einer Heizquelle | Gefäßwärme |
|---|---|---|
| Q = q·m | Q = Pth·t | QGef = K·ΔT |
| QS... Schmelzwärme QV... Verdampfungswärme qS... spezifische Schmelzwärme qV... spezifische Verdampfungswärme | Pth... thermische Leistung t... Zeit | K... Kalorimeterkonstante ΔT... Temperaturdifferenz (θMitte - θaußen) |
Wärmeaustausch: -Qabgegeben = Qaufgenommen
Hauptsätze der Thermodynamik
1. Hauptsatz der Thermodynamik:
- Mayer: Energie kann nicht verschwinden oder neu entstehen
- Helmholtz: Energie kann nicht verschwinden oder neu entstehen. Energie kann immer nur von einer Energieform in eine andere umgewandelt werden oder von einem Körper auf einen anderen übertragen werden
- Entdeckertum in Deutschland erst Helmholtz; in England Joule
- erst 1860 offizielle Anerkennung von J. Robert Mayer
- Unmöglichkeit des Perpetuum mobile 1. Art
- Innere Energie U: Summe aller Energien der Teilchen U∼T
- Energieerhaltungssatz
- Energiebilanz der über Systemgrenzen ausgetauschten Energie in Form von Wärme und/oder Arbeit
ΔU = Q + W
 | Isobare ΔU = Q + W Isochore W = 0 ΔU = Q Isotherme ΔU = 0 Q = -W Adiabate Q = 0 ΔU = W |
2. Hauptsatz der Thermodynamik:
- Es gibt keinen Prozess, bei dem Ausschließlich Wärme von einem kalten auf einen heißen Körper übergeht.
- Unmöglichkeit des Perpetuum mobile 2. Art
- Jedes abgeschlossene System strebt der Unordnung entgegen
- Beispiele:
- Informatik ⇒ Datenverlust
- Biologie ⇒ Kompost, Strukturverlust
Sie Energie ändert sich immer so, dass der neue Zustand wahrscheinlicher ist.
Entropie... Verhältnis Änderung innerer Energie zur Temperatur
reversibel... umkehrbarer Vorgang, Entropie bleibt konstant
irreversibel... nicht umkehrbarer Vorgang, Entropie nimmt zu
Kreisprozesse
| nach Carnot | nach Stirling |
|---|---|
 | 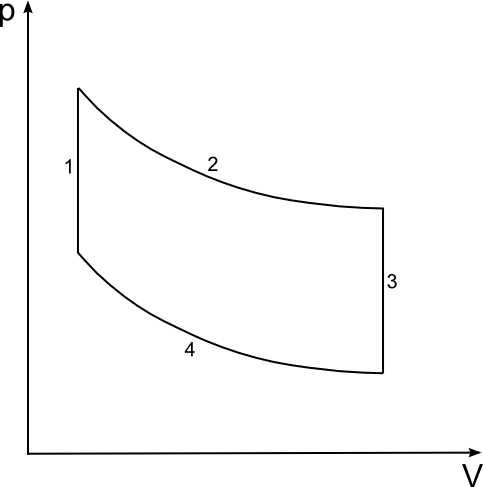 |
Gemeinsamkeiten:
| 2: isotherme Expansion | Q = -W | ΔU = 0 |
| 4: isotherme Kompression | -Q = W | ΔU = 0 |
Unterschiede:
| 1: adiabatische Kompression Q = 0 ΔU = W | 1: isochore Erwärmung W = 0 ΔU = 0 |
| 3: adiabatische Kompression Q = 0 ΔU = W | 3: isochore Abkühlung W = 0 ΔU = 0 |
Stirlingmotor:
1. Erwärmung bei konstantem Volumen ⇒ Gas verrichtet keine Arbeit
2. Expansion ohne Temperaturänderung ⇒ Energie wird zugeführt
3. Abkühlung bei konstantem Volumen ⇒ Energieabgabe, keine verrichtete Arbeit
4. Kompression ohne Temperaturänderung ⇒ Energieabgabe, am Gas wird Arbeit verrichtet
Wärmekraftmaschinen
4-Takt-Ottomotor:Aufbau:
Zylinder, Kolben, Ein- und Auslassventil, Kurbelwelle, Pleuelstange, ZündkerzeVorgänge:
| 1. Takt | 2. Takt | 3. Takt | 4. Takt | |
|---|---|---|---|---|
| Name | Ansaugtakt | Verdichtungstakt | Arbeitstakt | Ausstoßtakt |
| Vorgang | Ansaugen des Benzin - Luft - Gemisches | Verdichten des Benzin - Luft - Gemisches | Zünden und Verbrennen des Kraftstoff - Luft - Gemisches | Ausschieben des verbrannten Kraftstoffes (Abgase) |
| Richtung der Kolbenbewegung | Kurbelwelle | Zylinderkopf | Kurbelwelle | Zylinderkopf |
| Einlassventil | geöffnet | geschlossen | geschlossen | geschlossen |
| Auslassventil | geschlossen | geschlossen | geschlossen | geöffnet |
Arbeitsweise:
| 1. Takt: | Ansaugen, Einlassventil geöffnet ⇒ offenes System ⇒ 1. Hauptsatz nicht anwendbar |
| 2. Takt: | Ventile geschlossen, sehr schnelle Kompression; 1. Hauptsatz: adiabatische Kompression Q = 0 ⇒ U = WV (WV>0), Kompressionsarbeit wird zugeführt ⇒ T steigt |
| 3. Takt: | Zünden durch Zündfunken (Fremdzündung); sehr schnelle Temperaturerhöhung, Q wird zugeführt durch Verbrennung ⇒ Sprung auf isotherme höhere Temperatur, fast isochore Zustandsänderung ⇒ WV = 0 ⇒ Q = ΔU > 0 ⇒ T steigt anschließend, Ausdehnung des verbrannten Kraftstoff - Luft - Gemisches, adiabatische Expansion Q = 0 ⇒ WV < 0 (Expansion) ⇒ ΔU < 0 ⇒ T sinkt |
| 4. Takt: | Auslassventil geöffnet, kein abgeschlossenes System ⇒ 1. Hauptsatz nicht anwendbar |
Vergleich von Otto- und Dieselmotor:
| Ottomotor | Dieselmotor | |
|---|---|---|
| 1. Takt | Das (durch den Vergaser hergestellte) Kraftstoff - Luft - Gemisch wird angesaugt | Es wird reine Luft angesaugt |
| 2. Takt | Das Gemisch wird komprimiert; kurz vor dem oberen Totpunkt erfolgt die Zündung, wodurch Druck und Temperatur stark ansteigen | Die Luft wird so stark komprimiert, dass sich der eingespritzte Dieselkraftstoff durch die hohe Temperatur selbst entzündet |
| Zündung | Fremdzündung | Selbstzündung |
| 3. Takt | Das hochkomprimierte, erhitzte Gas dehnt sich aus und verrichtet mechanische Arbeit. Der Kolben bewegt sich vom oberen zum unteren Totpunkt. | Das hochkomprimierte, erhitzte Gas dehnt sich aus und verrichtet mechanische Arbeit. Der Kolben bewegt sich vom oberen zum unteren Totpunkt. |
| 4. Takt | Das Gas wird ausgestoßen. Ein Zyklus ist abgelaufen. Die Kurbelwelle hat sich zweimal gedreht. | Das Gas wird ausgestoßen. Ein Zyklus ist abgelaufen. Die Kurbelwelle hat sich zweimal gedreht. |
mögliche Idealisierung:
 |
|
T1T2
Wirkungsgrad: η =
EnutzEaufgebracht
=eingeschlossene Fläche∑Q + W
Q = H·m
H... Heizwert